Asins koagulācijas shēmas. Bioķīmija
Iii. Vērpšanas sistēma
BLOOD
Kad asinsvads ir bojāts, sākas reakciju kaskāde, kā rezultātā veidojas asins receklis - asins receklis, kas novērš asiņošanu. Galveno lomu asins koagulācijā (koagulācijā) spēlē trombocīti un vairāki plazmas proteīni.
Pārtraucot asiņošanu, ir 3 posmi. Pirmajā posmā asinsvads tiek samazināts. Tad traumas vietā ir pievienoti trombocīti, kas ir slāņoti viens otram, veidojot trombocītu spraudni (baltu trombu). Balts trombs ir trausls un var tikai bloķēt nelielu asinsvadu. Trešajā posmā asins plazmas šķīstošais proteīns, fibrinogēns, tiek pārveidots par nešķīstošu fibrīna proteīnu, kas nogulsnējas starp trombocītiem un veidojas spēcīgs fibrīna trombs. Šāds trombs satur sarkanās asins šūnas un tāpēc to sauc par sarkanu trombu.
Fibrīna trombu veidošanās sākas ar proteolītisku reakciju kaskādi, kas noved pie fermenta trombīna aktivācijas, kas fibrinogēnu pārvērš fibrīnā. Visas asins koagulācijā iesaistītās olbaltumvielas sauc par recēšanas faktoriem. Tos sintezē galvenokārt aknās un asins šūnās neaktīvo prekursoru formā, kas apzīmēti ar romiešu cipariem, bet tiem ir arī triviāli nosaukumi (14-1. Tabula). Lielākā daļa šo olbaltumvielu tiek aktivēti fermentu asins recēšanas reakciju kaskādē. Aktīvs
14-1. Tabula. Koagulācijas faktoru galvenās funkcijas un līmenis plazmā
| Faktors | T rivial nosaukums | Saturs asins plazmā, g / l | Funkcijas |
| 1 | 2 | 3 | 4 |
| I | Fibrinogēns | 2-4 | Šķīstošs fibrīna prekursoru proteīns |
| Ia | Fibrīns | Veido fibrīna gelu | |
| II | Protrombīns | 0,1 | Proenzyme * |
| IIa | Trombīns | Proteaze, kas pārveido fibrinogēnu uz fibrīnu un aktivējošiem faktoriem V, VII, VIII, XIII, C | |
| III | Audu faktors | Proteīna aktivatora membrānu komplekss VIIa-TF-Ca 2+ | |
| IV | Ca 2+ | 0,9-1,2 mmol / l | Mediē prokoagulanta ceļa fermentu mijiedarbību ar fosfatidilserīnu |
| V | Proakcerolīns | 0,01 | Olbaltumvielu aktivatora membrānas kompleksa Xa-Va-Ca 2+ priekštecis |
| Va | Accelerin | Membrānas kompleksa Xa-Va-Ca 2+ proteīnu aktivators | |
| VII | Proconvertins | 0,005 | Proenzyme * |
| VIIa | Konvertēt | Proteaze *, aktivējošie faktori X un IX | |
| Viii | Neaktīvs antihemofilais faktors A (neaktīvs antihemofils globulīns) | 0,01-0,02 | Olbaltumvielu aktivatora membrānas kompleksa IXa-VIIIa-Ca 2+ priekštecis |
| VIIIa | Aktīvais antihemofilais faktors A (aktīvais antihemofilais globulīns) | IXa-VIIIa-Ca 2+ membrānu kompleksa proteīnu aktivators | |
| Ix | Neaktīvs antihemofilais faktors B (neaktīvs Ziemassvētku faktors) | 0,003 | Proenzyme * |
| Ixa | Aktīvs antihemofilais faktors B (aktīvs Ziemassvētku faktors) | Proteaze *, aktivējošais faktors X | |
| X | Neaktīvs faktors Stuart-Prouer | 0,01 | Proenzyme * |
| Xa | Stuart Prouer aktīvais faktors | Proteāze *, aktivējošais faktors II | |
| Xi | Neaktīva plazmas tromboplastīna prekursors | 0,005 |
14-1. Tabulas turpinājums
| 1 | 2 | 3 | 4 |
| Xia | Aktīvā plazmas tromboplastīna prekursors | Proteāzes aktivējošais faktors IX | |
| Xii | Neaktīvs Hagemana faktors | 0,03 | Koenzīma kontakta ceļa enzīms |
| Xii | Aktīvais faktors Hagemans | Proteāze, aktivējošais faktors XI, prekallikreīns, plazminogēns | |
| XIII | Neaktīvs transglutamidāze (neaktīvs fibrīna bazalizācijas faktors) | 0,01-0,02 | Proenzīms |
| Hsh | Aktīvais transglutamidāze (aktīvais fibrinstabilizācijas faktors) | Katalizē amīda saiknes veidošanos starp fibrīna monomēra, fibrīna un fibronektīna molekulām | |
| Prekashkrein | 0,05 | Koenzīma kontakta ceļa enzīms | |
| Kallikrein | Proteāze, aktivējošais faktors XII, plazminogēns | ||
| VMK | 0,06 | Asins koagulācijas kontakta ceļa proteīna aktivators |
* Satur karboksiglutamīnskābes atlikumus, kas nepieciešami, lai veidotos prokoagulanta koagulācijas ceļa membrānas fermentu kompleksi.
šo proteīnu formas apzīmē ar tiem pašiem romiešu cipariem, bet ar burtu "a".
A. Fibrīna trombu veidošanās
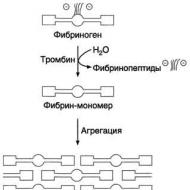
Fibrīna trombu veidošanās sākas ar fibrinogēna asins plazmas šķīstošā proteīna pārveidošanu nešķīstošā fibrīnā.
Fibrinogēns(I faktors) ir glikoproteīns ar molekulmasu 340 kD. To sintezē aknās, un tas atrodas asins plazmā koncentrācijā 8,02–12,9 µmol / L (2–4 g / l). Fibrinogēna molekula sastāv no sešām polipeptīdu ķēdēm, kas ir savstarpēji saistītas ar disulfīda saitēm. Fibrinogēna molekulas polipeptīdu ķēžu sastāvs ir apzīmēts ar αα 2, β 2, γ 2 lielajiem burtiem atbilst tām jomām, kuras tiek sadalītas trombīna iedarbības laikā, pārveidojot fibrinogēnu uz fibrīnu. Fragmentos A ķēdēs A un B ķēdēs Bβ ir liels aspartāta un glutamāta atlikumu daudzums. Tas rada spēcīgu negatīvu lādiņu Fibrinogēna molekulu N-galos un novērš to agregāciju.
Fibrinogēna molekula sastāv no trim globulāriem domēniem, pa vienam katrā molekulas galā (domēni D) un vienu vidū (E domēns). Domēni tiek atdalīti viens no otra ar polipeptīdu ķēžu sekcijām, kurām ir stieņa veida konfigurācija. Ķēdes A un Bβ N-gala fragmenti A un B izvirzās no centrālā domēna E (14-8. Att.).
Fibrīna trombu veidošanā var izšķirt 4 stadijas.
1. Fibrinogēna konversija uz fibrīna monomēru. Pirmkārt, fibrinogēna molekulas tiek atbrīvotas no negatīvi lādētiem A un B fragmentiem, kā rezultātā veidojas fibrīna monomēri. Fibrinogēna (I faktora) pārveidošanos par fibrīnu (1.a faktors) katalizē enzīms trombīns (faktors Pa). Katrā fibrinogēna molekulā trombīns hidrolizē četras peptīda saites ar arginilglicilu, no kuriem divi savieno fragmentus ar a-ķēdi,
Att. 14-8. Fibrinogēna struktūra. Fibrinogēns sastāv no sešām polipeptīdu ķēdēm: Аα 2, β 2 un γ 2. A, B - negatīvi lādēti fragmenti, kuru dēļ fibrinogēna molekulas nesagatavojas. D, E - fibrinogēna molekulas globālie domēni. Domēni tiek atdalīti ar polipeptīdu ķēžu sekcijām, kurām ir stieņa veida konfigurācija. No centrālās globulārās domēna E ķēdes A2 un Bβ2 fragmentu A un B N-gala daļas izvirzās.
un pārējie divi ir B ar β-ķēdi fibrinogēna A 2 un β 2 ķēdēs. Fibrīna monomeram, kas veidojas no fibrinogēna, ir sastāvs (α, β, γ) 2.
2. Nešķīstoša fibrīna gela veidošanās. Otrajā posmā veidojas nešķīstošs polimēra fibrīna receklis - fibrīna gēls. Fibrinogēna konversijas rezultātā fibrīna monomērā domēns E atver saistošos punktus uz domēniem D. Turklāt domēns E satur agregācijas centrus, kas veidojas tikai pēc fibrinogēna daļējas proteolīzes trombīna iedarbībā, un D domēns ir pastāvīgo agregācijas centru nesējs. Fibrīna molekulu primārā agregācija notiek vienas molekulas E domēna saistīšanās vietu mijiedarbības rezultātā ar citu molekulu D domēnu komplementārajiem reģioniem, tādējādi starp fibrīna-monomēra molekulu domēniem veidojas nekovalentās saites. Kad fibrīna gēla "savāc", vispirms tiek veidoti dubultās šuves, kurās fibrīna molekulas tiek pārvietotas viena pret otru par 1/2 garuma. Pēc tam, kad protofibrils sasniedz noteiktu kritisko garumu, sākas to sānu savienojums, kas noved pie biezu fibrīna šķiedru veidošanās (14.-9. Attēls). Iegūtais fibrīna gēls ir trausls, jo tajā esošās fibrīna molekulas ir savstarpēji savienotas ar ne-kovalentām saitēm.
3. Fibrīna gēla stabilizācija. Kā rezultātā amīda saites veidošanos starp vienas fibrīna molekulas lizīna atlikumiem un citas molekulas glutamīna atlikumiem, fibrīna gēls stabilizējas. Transamidāzes enzīmu katalizē transglutamidāzes enzīms (XIIIa faktors) (14-10. Att.). XIII faktors tiek aktivizēts ar trombīna daļēju proteolīzi.
Transglutamidāze arī veido amīda saiknes starp fibriīnu un fibronektīnu, ekstracelulārās matricas glikoproteīnu un asins plazmu (skatīt 15. sadaļu). Tādējādi asins receklis ir nostiprināts uz vietas, kurā bojāts kuģis.
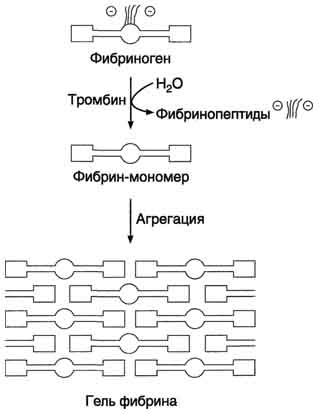
Att. 14-9. Fibrīna gela veidošanās. Fibrinogēns, kas atbrīvots no trombīna no negatīvi uzlādētiem fragmentiem (fibrinopeptīdi 2A un 2B), tiek pārveidots par fibrīna monomēru. Fibrīna monomēra E- un D-domēnu komplementāro reģionu mijiedarbības rezultātā pirmoreiz lineāra un pēc tam molekulu polimerizācija notiek ar fibrīna gela veidošanos.

4. Fibrīna recekļa izņemšana. Gēla saspiešana (retraktācija) nodrošina aktomiozīna trombocītu kontrakcijas proteīnu trombostenīnu, kam ir ATP-ase aktivitāte. Trombostenīns ir iesaistīts arī trombocītu aktivācijā un agregācijā. Asins recekļu atgriešanās novērš pilnīgu asinsvadu bloķēšanu, radot iespēju atjaunot asins plūsmu.
Asins recekļu veidošanās mehānismā ir trīs funkcionāli atšķirīgi posmi: prokoagulanta ceļš, kontakta ceļš un antikoagulanta fāze, kas novērš asins recekļa izplatīšanos.
B. Prokoagulants asins koagulācijas veids
Lai pārtrauktu asiņošanu no kapilāriem un asinsvadiem, ir nepieciešama strauja trombu veidošanās, kas novērš asins zudumu. Tas tiek panākts, veicot fermentu reakciju kaskādi ar pastiprināšanas mehānismiem daudzos posmos.
Prokoagulanta ceļš ir galvenais asins recēšanas elements (14.-11. Attēls).
Cirkulējošā asinīs ir proteolītisko enzīmu proenzīmi: II faktors (protrombīns), VII faktors (proconvertīns), faktors IX (Ziemassvētki), faktors X (Stewart). Faktori Va (akselerīns) un VIIIa (antihemofils faktors) un membrānas proteīns - audu faktors (TF, III faktors) asinīs ir šo fermentu aktivatora proteīni (14-1. Tabula).
Kad kuģis ir bojāts, enzīma aktivācijas kaskādes mehānisms tiek aktivizēts ar secīgu trīs fermentu kompleksu veidošanos, kas saistīti ar šūnu membrānas fosfolipīdiem. Katrs komplekss sastāv no proteolītiskā enzīma, aktivatora proteīna un Ca2 + joniem: VIIa-TO-Ca2+, IXa-VIIIa-Ca2+ (tenāze), Xa-Va-Ca 2+ (protrombināze) (14. att. 12). Xa-Va-Ca 2+ komplekss (protrombināzes komplekss) aktivizē protrombīnu (II faktors). Enzīmu reakciju kaskāde beidzas ar fibrīna monomēru veidošanos un pēc tam veidojas asins receklis.
Kaskādes enzīmu aktivācijā tiek izdalīti trīs galvenie mehānismi: daļēja proteolīze, mijiedarbība ar aktivatora proteīniem un mijiedarbība ar modificētām šūnu membrānām.
Aktivizācija ar daļēju proteolīzi.Visi procoagulanta ceļa fermenti ir serīna proteāzes, tie tiek sintezēti aknās kā neaktīvi profili un cirkulē šajā formā asinīs. Trombogēna signāla ieviešanas procesā proenzīmi (VII, IX, X un II faktori) tiek pārveidoti ar daļēju proteolīzi par aktīviem fermentiem.
Trombīns (Pa koeficients)- glikoproteīns ar molekulmasu 39 kD. Tas veidojas asinīs no neaktīva protrombīna prekursora. Protrombīns tiek sintezēts aknās, molekulmasa ir 70 kDa un satur atlikumus
Att. 14-11. Prokoagulanta koagulācijas ceļš. → asins koagulācijas faktoru aktivizēšana; ····\u003e koagulācijas faktoru aktivizēšana, pamatojoties uz pozitīvu atgriezenisko saiti; Enz fermentu kompleksu membrānas fosfolipīda komponents. Ierāmētas rāmju proteīnu aktivatori. 1,2-faktora VIIa membrānas komplekss VIIa-TF-CA 2+ aktivizē faktorus IX un X; 3-faktora IXa membrānas komplekss IXa-VIIIa-Ca 2+ aktivizē X faktoru; Xa-Va-Ca 2+ membrānu kompleksa 4, 5-faktors Xa pārvērš protrombīnu (II faktors) uz trombīnu (IIa faktors) un aktivizē VII faktoru; 6-10 - trombīns (IIa faktors) pārvērš nešķīstošo fibrinogēnu šķīstošā fibrīnā, aktivizē VII, VIII, V un XIII faktorus.
γ-karboksiglutamīnskābe. Šīs olbaltumvielas koncentrācija asinīs parasti ir 0,1 g / l. Tas ir fiksēts uz Xa-Va-Ca 2+ membrānas enzīmu kompleksa, mijiedarbojoties, no vienas puses, ar γ-karboksiglutamāta atlikumiem ar Ca 2 +, un, no otras puses, tieši ar aktivējošo proteīnu Va. Tādējādi tiek radīti labākie sterīlie apstākļi fermentatīvās reakcijas rašanās gadījumā. Xa faktors protrombīna molekulā hidrolizē divas peptīdu saites. Rezultātā veidojas trombīna molekula, kas sastāv no divām ķēdēm - vieglas un smagas, savienotas ar vienu disulfīda saiti (14.-12. Attēls). Trombīna molekula nesatur γ-karboksiglutamāta atlikumus un atbrīvojas no protrombināzes kompleksa. Trombīns ar daļēju proteolīzi pārvērš fibrinogēnu fibrīnā un aktivizē VII, VIII, V, XIII faktorus.
Trombīns veic vairākas svarīgas fizioloģiskas funkcijas: tas ir prokoagulantu un kontaktu ceļu asins recēšanas ceļš, ierosina antikoagulanta fāzes reakciju, izraisa trombocītu agregāciju un ir mitogēna iedarbība, piedaloties šūnu proliferācijā un remontā.
V un VIII faktori tiek aktivizēti arī ar daļēju proteolīzi, attiecīgi pārvēršoties par faktoriem Va un VIIIa. Šo faktoru aktivizēšanas rezultātā palielinās to konformācijas izmaiņas un afinitāte pret membrānas fosfolipīdiem un fermentiem.
Olbaltumvielu aktivatoru mijiedarbība ar proteolītiskiem enzīmiem.Audu faktors, faktors Va un VIIIa faktors satur attiecīgi membrānu fosfolipīdu un VIIa, IXa un Xa fermentu saistīšanās vietas. Saistoties ar aktivatora proteīniem konformācijas izmaiņu rezultātā, šo fermentu aktivitāte palielinās.
Audu faktors (III faktors)ir komplekss, kas sastāv no proteīna un fosfatidilserīna. Audu faktora proteīna daļa (apoproteīns III) ir pakļauta daudzu šūnu (smadzeņu, plaušu, aknu, liesas uc) virsmai un ir saistīta ar fosfatidilserīna plazmas membrānām. Tomēr, apoproteīna III parādīšanās uz šūnu virsmas

Att. 14-12. Protrombīna proteolītiskā aktivācija ar protrombināzes kompleksa Xa faktoru. ![]() - karboksiglutamīnskābes atliekas; bultiņas norāda protrombīna molekulā hidrolizēto peptīdu saiti. Protrombīna molekula sastāv no vienas polipeptīdu ķēdes, un trombīns, ko veido protrombīna daļēja proteolīze, sastāv no divām polipeptīdu ķēdēm, kas savienotas ar vienu disulfīda saiti.
- karboksiglutamīnskābes atliekas; bultiņas norāda protrombīna molekulā hidrolizēto peptīdu saiti. Protrombīna molekula sastāv no vienas polipeptīdu ķēdes, un trombīns, ko veido protrombīna daļēja proteolīze, sastāv no divām polipeptīdu ķēdēm, kas savienotas ar vienu disulfīda saiti.
pieskaroties asinīm (eudothelial un monocytes), notiek tikai noteiktos apstākļos: traumas bojājuma gadījumā un / vai to plazmas membrānu normālas asimetrijas izjaukšana. Audu faktors proteolītiskajā aktivācijā nav nepieciešams.
V faktors un VIII faktors -asinīs cirkulējošie domēna proteīni. V faktoru sintezē aknās, un VIII faktors tiek sintezēts endotēlija šūnās. Abus faktorus aktivizē trombīna daļēja proteolīze. VIII faktors plazmā tiek kombinēts ar von Willebrand proteīnu - trombocītu faktoru. Von Willebrand faktors šajā kompleksā stabilizē VIII faktoru, novēršot tā iznīcināšanu ar antikoagulantu fāzes pro-anolītisko enzīmu, izmantojot faktoru Ca.
Enzīmu kompleksu mijiedarbība ar šūnu membrānāmnotiek ar jonu Ca 2+ līdzdalību. Visi procoagulanta ceļa (II, VII, IX, X) rezultāti satur u-karboksiglutamīnskābes atlikumus, kas rodas pēc šo proteīnu pārveidošanas hepatocītu ER.
Γ-karboksiglutamīnskābes atlikumi faktoros VIIa, IXa un Xa nodrošina šo enzīmu mijiedarbību ar Ca 2+ ar negatīvi lādētu šūnu membrānu fosfolipīdiem. Ja nav Ca 2+ jonu, asinis nesaņem.
K vitamīna loma glutamīnskābes atlikumu karboksilēšanā prokoagulanta koagulācijas ceļa proenzīmos. Glutamīnskābes atlikumu karboksilāciju procoagulanta ceļa profilā katalizē karboksilāze, kuras koenzīms ir samazināts K vitamīna (naftohinons) - vitamīna K dihidrokinons (skatīt 3. sadaļu).
K vitamīns (nafto-hinons), kas uzņemts, tiek atjaunots aknās ar NADPH atkarīgu K vitamīna reduktāzi, veidojot K vitamīna dihidrokinonu. K. Epoksīda reģenerācija K vitamīna dihidrokinonā notiek šādi: pirmkārt, tiolam atkarīgā epoksīda reduktāze, kuras koenzīms ir proteīns, atjaunojas K vitamīna 2,3-epoksīdam. apstiprināts. Pēc tam šajā reakcijā iegūtais K vitamīns tiek atjaunots ar fermenta K vitamīnu, ko izraisa tiola atkarīgais reduktāze K vitamīna dihidrokinonā.

Att. 14-13. K vitamīna loma glutamīnskābes karboksilācijā pēc translācijas. 1 - eksogēnā K vitamīna NADPH atkarīgā reduktāzes atgūšana; 2 - γ-karboksilēšana glutamīnskābes atlikumos II, VII, IX, X, C proteīna, K vitamīna atkarīgā karboksilāzē ir saistīta ar dihidrokinona oksidēšanos ar 2,3-epoksīda K vitamīna veidošanos; 3 - 2,3-epoksīda tiola atkarīgā K vitamīna reduktāzes atgūšana; 4 - no K vitamīna atkarīgā vitamīna K reduktāzes reģenerācija; a) un b) - tioredoksīna tipa proteīnu reducētās un oksidētās formas.
šī reakcija, kā arī iepriekšējā reakcija, ir tioredoksīna tipa proteīns (14-13. att.). K vitamīna deficīts noved pie prokoagulanta ceļa gāzu karboksilācijas traucējumiem, un to pavada asiņošana, subkutānas un iekšējās asiņošanas.
K vitamīna strukturālie analogi, dicumarols un varfarīns, inhibē tiola atkarīgos fermentus K-2,3-epoksīda reduktāzi un K vitamīna reduktāzi, izraisot asins koagulācijas inhibīciju (14.-14. Att.). Šīs zāles tiek izmantotas klīniskajā praksē, lai novērstu trombozi.
Prokoagulantu reakcijas reakciju kaskādes uzsākšana.Prokoagulanta ceļa enzīmu membrānas kompleksi veidojas tikai tad, ja uz plazmas membrānas ārējās virsmas ir audu faktoru šūnas un negatīvi lādēti fosfolipīdi. Jo īpaši plazmas membrānu šķērsvirziena asimetriju nosaka neitrālo fosfolipīdu (fosfatidil-holīna un sfingomielīna) pārsvars ārējā slānī un negatīvi uzlādēts (fosfatidil inozitol-bisfosfāts un fosfatidil serīns) iekšējā slānī (skatīt 5. nodaļu). Īpašs fermentu sysgema nodrošina transmembrānu pārnesi un fosfolipīdu izplatīšanos šūnu membrānās, kurās šūnu plazmas membrānas ārējā virsma parasti nav uzlādēta (skatīt 5. nodaļu).
Ja tiek traucēta trombocītu membrānu un endotēlija šūnu šķērseniskā asimetrija, uz virsmas veidojas negatīvi lādētas (trombogēnas) zonas un tiek pakļauts audu faktora apoproteīns III. Šādi pārkāpumi var rasties fiziska kaitējuma gadījumā. Šajā gadījumā audu faktors un šūnu membrānas iekšējās virsmas kļūst pieejamas prokoagulanta ceļa plazmas faktoriem. Turklāt signalizācijas molekulu mijiedarbība, kas izraisa trombogēnu veidošanos ar endotēlija šūnu un trombocītu receptoriem, aktivizē Ca 2 + atkarīgās regulēšanas sistēmas (skatīt 5. nodaļu). Galu galā tas noved pie Ca2 + satura pieauguma citoplazmā, kas inhibē no ATP atkarīgo aminofosfolipīda translokāzi. Šim fermentam ir svarīga loma membrānu šķērsvirziena asimetrijas saglabāšanā, jo tā pārvieto fosfātu-tidilserīnu no ārējā lipīdu slāņa uz iekšējo. Aminofosfolipīda translokāzes aktivitātes samazināšanās izraisa fosfatidilserīna satura palielināšanos šūnu membrānas ārējā slānī un negatīvi lādētu reģionu veidošanos, kas nepieciešami membrānu fermentu kompleksu veidošanai. Turklāt šāda plazmas membrānas struktūras pārkāpuma rezultātā tā ārējā virsmā tiek pakļauts audu faktors, un veidojas pirmais prokoagulanta koagulācijas ceļa VII-TF-Ca 2+ fermentu komplekss.

Katra kompleksa fermentu aktivizācija ir visu tā komponentu mijiedarbības rezultāts. Ja IX, X un II faktoriem nepieciešama aktivācija, tad VII faktors ir zems proteolītiskās aktivitātes līmenis. VII-TF-Ca 2+ membrānas kompleksa VII faktors ar daļēju proteolīzi aktivizē IX un X faktorus. Aktīvie faktori IXa un Xa ir iesaistīti membrānu kompleksu IXa-VIIIa-Ca2 + un Xa-Va-Ca 2+ veidošanā. Tajā pašā laikā Xa faktors proteolītiski aktivizē V faktoru, un protrombināzes komplekss ne tikai pārvērš protrombīnu par trombīnu, bet arī aktivizē VII faktoru, kura proteolītiskā aktivitāte kompleksā VIIa-Tf-Ca 2+ ir 10 000 reižu lielāka nekā kompleksā VII-Tf- Ca 2+.
Trombīns, kas veidojas reakciju kaskādes rezultātā, katalizē fibrinogēna daļēja proteolīzes reakciju, XIII faktoru, un ar pozitīvas atgriezeniskās saites principu proteolītiski aktivizē faktorus V, VII un VIII.
Koagulācijas procesā ir divi signālu pastiprināšanas mehānismi: reakciju kaskāde, kurā katra enzīmu saite nodrošina signāla pastiprināšanu un pozitīvas atgriezeniskās saites.
B. Asins recēšanas ceļš
Asins koagulācijas kontaktu ceļš sākas ar proformenta XII faktora mijiedarbību ar bojātu endotēlija virsmu
Att. 14-15. Prokoagulantu (ārējo) un kontaktu (iekšējo) asinsreces ceļu diagramma. Apzīmējumi: IUD - kinologēns ar augstu molekulmasu; TF - audu faktors; → - asins koagulācijas faktoru aktivizēšana; · Atcelšana\u003e koagulācijas faktoru aktivizēšana, pamatojoties uz pozitīvu atgriezenisko saiti; ▄▄ - fermentu kompleksu membrānas fosfolipīda komponents. Visi asins koagulācijas membrānu kompleksu fermenti ir proteāzes un tiek aktivizēti ar daļēju proteolīzi. 1 - faktors XII, kas aktivizēts saskarē ar subendotēliju, pārvērš prekallikreīnu par kallikreīnu; 2 - kallikreīna membrānas komplekss kallikreīns-IUD aktivizē XII faktoru; 3 - faktors XIIa aktivizē XI faktoru; 4 - faktors XIIa, ko aktivizē daļēja proteolīze, pārveido prekallikreīnu par kallikreīnu saskaņā ar pozitīvas atgriezeniskās saites principu; 5 - faktora XIa membrānas komplekss XIa-BMK aktivizē IX faktoru; 6-faktors (Xa membrānu komplekss IXa-VIIIa-Ca 2+ aktivizē X faktoru; 7, 8 - VIIa faktora membrānas komplekss VIIa-Tf-Ca 2+ aktivizē IX un X faktorus; 9 - protrombināzes kompleksa Xa faktors aktivizē II faktoru; 11 - trombīns (II faktors) pārvērš fibrinogēnu uz fibrīnu un aktivizē XIII faktoru, 12 - faktors XIIIa katalizē amīda saites veidošanos fibrīna gēlā.
asinsvadu siena. Šī mijiedarbība izraisa XII faktora aktivāciju un ierosina membrānas enzīmu kompleksu veidošanos koagulācijas kontakta fāzē. Tās satur fermentus kallikreīnu, XIa faktoru (tromboplastīna plazmas prekursoru) un XIIa (Hagemana faktors), kā arī aktivatora proteīnu - kinologēnu (molekulmasu) (14.-15. Att.).
XII faktors- asinīs cirkulējošā spēja. To secīgi aktivizē divos veidos: pirmkārt, konformācijas izmaiņu rezultātā, mijiedarbojoties ar bojātu endotēlija negatīvo lādēto virsmu, pēc tam ar daļēju proteolīzi ar kalikreīna-VMC membrānu kompleksu.
Augstas molekulmasas kininogēns -proteīna aktivators fermentu membrānas kompleksos XIIa-IUD, Xla-BMK un kallikrein-IUD. VMC ir plazmas glikoproteīns, ko sintezē aknās un kura molekulmasa ir 120 kD. Tā mediē asins koagulācijas kontakta fāzes proteolītisko enzīmu mijiedarbību ar kolagēna subendotēliju, turklāt tā ir sastāvdaļa kallik-rein-kinīna sistēmā.
Kallikrein- serīna proteāze, kuras substrāti papildus XII faktoram ir plazmas olbaltumvielas plazminogēns (proenzīms, kas iesaistīts fibrīna izšķīdināšanā) un kininogēni ar zemu (69 kD) un augstu (120 kD) molekulmasu. Kininogēnu daļēja proteolīze rada regulējošus kinīna peptīdus. Jo īpaši spēcīgs vazodilatators bradikinīns palielina asinsvadu caurlaidību un izraisa endotēlija šūnu membrānu iznīcināšanu.
Tā kā XII faktors saskaras ar asinsvadu subendotēliju, tas tiek aktivizēts. Aktīvais faktors XIIa kompleksā ar IUD proteolītiski
pārvērš prekallikreīnu, kas saistīts ar membrānu caur IUD, kallikreīnā. Kallikreīna-IUD membrānu komplekss, pamatojoties uz pozitīvu atgriezenisko saiti ar daļēju proteolīzi, aktivizē XII faktoru. Tajā pašā laikā XII faktors iegūst maksimālu enzīmu aktivitāti un, izmantojot pozitīvas atgriezeniskās saites principu, aktivizē prekallikreīnu, kas saistīts ar IUD. Turklāt XIIa faktors, kas veidojas daļējas proteolīzes rezultātā, aktivizē XI faktoru proteolītiski, un XI faktors fermenta kompleksa XIa - IUD sastāvā aktivizē IX faktoru. 1Xa-VIIIa-Ca 2+ membrānas kompleksa IXA faktors aktivizē X faktoru, kas protrombināzes kompleksā aktivē protrombīnu.
Reakciju kaskādi, kas noved pie trombīna veidošanās, var tikt realizēta divos veidos - pro-koagulants (ārējais) un kontakts (iekšējais) (14.-15. Att.). Lai uzsāktu ārējā ceļa reakcijas, ir nepieciešama audu faktora parādīšanās uz asins plazmas membrānas ārējās virsmas. Iekšējais ceļš sākas ar XII faktora aktivāciju, saskaroties ar bojāto asinsvadu endotēlija virsmu un prekallikreīna enzīmu savstarpējo aktivāciju un XII faktoru.
Tādējādi prokoagulantu un kontaktu ceļā asins koagulācija, secīga membrānu enzīmu kompleksu veidošanās noved pie X faktora aktivācijas un protrombināzes veidošanās. Pakāpes, kas abiem asins recēšanas veidiem ir vienādas, sauc par parasto asins koagulāciju. Pašlaik iekšējo un ārējo koagulācijas ceļu jēdziens tiek uzskatīts par nosacītu, jo kļuva skaidrs, ka UPA-TF-Ca 2+ komplekss efektīvāk aktivizē IX faktoru nekā X faktors, un VII faktors tiek aktivizēts ar faktoru 1Xa, lai gan ievērojami lēnāks. pret aktivācijas koeficientu Xa. Tāpēc var pieņemt, ka asins koagulācijas reakciju kaskāde notiek galvenokārt lineārā secībā, nevis gar divām salīdzinoši neatkarīgām trajektorijām. Kontakta ceļš acīmredzot nav absolūti nepieciešams, lai sāktu recēšanu; acīmredzot tas kalpo, lai savienotu asins koagulācijas sistēmu ar dažādām ķermeņa regulēšanas sistēmām, piemēram, kallikreīna-kinīna un fibrinolīzes fermentu sistēmu, kas izšķīst trombu.
Veselīgas personas asinis in vitrokoagulē 5-10 min. Šajā gadījumā protrombināzes kompleksa veidošanās aizņem 5–8 minūtes, protrombīna aktivācija aizņem 2–5 sekundes un fibrinogēna konversija uz fibrīnu aizņem 2–5 sekundes.
Samazināta asins recēšana.Samazinoties asins koagulācijai, tiek novērotas slimības, kas saistītas ar atkārtotu asiņošanu. Hemofilija ir iedzimta slimība, ko raksturo pastiprināta asiņošana. Šo asiņošanas cēlonis (spontāns vai traumas izraisīts) ir asins koagulācijas sistēmas proteīnu iedzimta nepietiekamība.
HemofilijaA (klasiskā hemofilija) izraisa VIII faktora gēna mutācija, kas lokalizēta X hromosomā. Klasiskā hemofilija veido 80% no visiem hemofilijas gadījumiem. B hemofilija ir mazāk izplatīta un to izraisa IX faktora ģenētiskais defekts.
VIII faktora gēna defekts izpaužas kā recesīvs iezīme, tāpēc tikai vīrieši slimo ar šo hemofilijas formu. Šo slimību pavada subkutāna, intramuskulāra un intraartikulāra asiņošana, dažreiz dzīvībai bīstama. VIII faktora defekts rodas aptuveni vienā no 10 000 jaundzimušajiem. Pacientus ārstē ar preparātiem, kas satur VIII faktoru, kas iegūti no donora asinīm vai ar gēnu inženierijas metodēm.
G. Asins antikoagulantu sistēma
Asins koagulācijas fizioloģiskajiem inhibitoriem ir svarīga loma hemostāzes uzturēšanā, jo tie saglabā asinis šķidrā stāvoklī un novērš asins recekļa izplatīšanos ārpus bojātās zonas.
Trombīnu, kas veidojas prokoagulantu un asins koagulācijas kontakta ceļu reakciju rezultātā, izplata ar asins plūsmu no trombiem. To var inaktivēt, mijiedarbojoties ar asins recēšanas enzīmu inhibitoriem vai aktivizējot antikoagulantu fāzi, kas kavē asins recekļa veidošanos.
Antikoagulanta fāze.Asins koagulācijai jābūt ierobežotai ne tikai kosmosā, bet arī laikā. Antikoagulanta fāze
ierobežo aktīvo faktoru kalpošanas laiku asinīs un to uzsāk pati trombīns. Līdz ar to, no vienas puses, trombīns paātrina asins koagulāciju, kas ir pēdējais enzīms koagulācijas reakciju kaskādē, un, no otras puses, palēnina to veidošanos, izraisot antikoagulanta fāzes fermentu kompleksu uz neskartiem asinsvadu endotēlijiem. Šis posms ir īss reakciju kaskāde, kurā, izņemot trombīnu, ir iesaistīti proteīna aktivatora trombomodulīns (Tm), K-vitamīna atkarīgais serīna proteāzes proteīns C, proteīna aktivators S un faktori Va un VIIIa (14.-16. Att.).
Antikoagulanta fāzes reakciju kaskādē secīgi veidojas 2 membrānu kompleksi IIa-Tm-Ca 2+ un Ca-S-Ca 2+.
Trombomodulīns- endotēlija šūnu membrānu neatņemama olbaltumviela. Tam nav nepieciešama proteolītiska aktivācija un kalpo kā trombīna aktivators. Trombīns iegūst spēju aktivizēt C olbaltumvielu tikai pēc mijiedarbības ar trombomodulīnu, un trombīns, kas saistīts ar trombomodulīnu, nevar pārvērst fibrinogēnu uz fibrīnu, neiedarbojas ar V faktoru un trombocītiem.
C proteīns- proferācija, kas satur γ-karboksiglutamāta atlikumus. Trombīns membrānas kompleksā IIa-Tm-Ca 2+ aktivizē proteīnu C ar daļēju proteolīzi, un aktivētais proteīns C (Ca) veido membrānu saistītu aktivatora proteīnu S

Att. 14-16. Antikoagulanta fāze. Tm - trombomodulīns; C - proteīns C; Ca-aktīvais proteīns C; S - proteīns S; tauku līnijas - ar membrānu saistīts komplekss. 1 - trombīns (Na) veido membrānas kompleksu ar proteīna trombomodulīnu (Tm); 2 - trombīns membrānas kompleksa sastāvā Ia-Tm-Ca 2+ aktivizē proteīnu C; 3 - aktivētais proteīns C Ca - S - Ca 2+ enzīma membrānas kompleksa sastāvā hidrolizē 2 peptīdu saites Va un VIIIa faktoros un pārvērš tos par neaktīviem peptīdiem.
komplekss Ca-S-Ca 2+. Ca kā daļa no šī kompleksa hidrolizē divas peptīdu saites Va un VIIIa faktoros un inaktivē šos faktorus. Kompleksa Ca-S-Ca 2+ iedarbība 3 minūtes. Tiek zaudēti 80% VIIIa un Va faktoru aktivitātes. Tādējādi, trombīns, izmantojot pozitīvu atgriezenisko saiti, ne tikai paātrina tā veidošanos, bet arī, aktivizējot proteīnu C, inhibē asins koagulācijas procesu.
C un S proteīna iedzimts trūkums noved pie VIIIa un Va faktoru inaktivācijas ātruma samazināšanās, un to pavada tromboze slimība. V faktora V gēna mutācija, kas sintezē V faktoru, rezistence pret proteīnu C, izraisa arī trombogēnu.
Antikoagulantu fāze izraisa asins koagulācijas kaskādes inhibīciju, un koagulācijas enzīmu inhibitori inaktivē aktīvos fermentus asinsritē.
Asins koagulācijas fermentu inhibitori.Asins koagulācijas enzīmu fizioloģiskie inhibitori ierobežo asins recekļa izplatīšanos uz vietu, kurā bojāts kuģis. Plazmas olbaltumvielas antitrombīns III- spēcīgākais asins koagulācijas inhibitors; tas veido aptuveni 80-90% no asins antikoagulanta aktivitātes. Tā inaktivē virkni serīna proteīnu: trombīnu, IXa, Xa, XIIa, kallikreīnu, plazminu un urokināzi. Antitrombīns III neinhibē VIIIa faktoru un neietekmē membrānu kompleksu sastāva faktorus, bet likvidē asins plazmā esošos fermentus, novēršot trombu veidošanos asinsritē.
Antitrombīna mijiedarbība ar asins recēšanas enzīmiem tiek paātrināta heparīna klātbūtnē. Heparīns ir heteropolisaharīds, ko sintezē masta šūnās. Mijiedarbības ar heparīnu rezultātā antitrombīns III iegūst konformāciju, kurā palielinās tā afinitāte pret serīna proteāzēm asinīs. Pēc antitrombīna III-heparīna enzīma kompleksa veidošanās, no tā atbrīvojas heparīns un var pievienoties citām antitrombīna molekulām.
Ar iedzimtu antitrombīna III trūkumu jau sen ir novērota dzīvībai bīstama tromboze un asinsvadu embolija.
α 2 - makroglobulīnsveido asins kompleksu ar serīna proteāzēm. Šādā kompleksā to aktīvais centrs nav pilnībā bloķēts,
un tie var mijiedarboties ar maziem substrātiem. Tomēr augsta molekulārā substrāti, piemēram, fibrinogēns, kļūst nepieejami proteažu iedarbībai α 2 -mikroglobulinthrombīna kompleksā.
Antikonversion (ārējā koagulācijas ceļa audu inhibitors)sintezēts asinsvadu endotēlijā. Tas specifiski saistās ar Tf-VIIa-Ca 2+ fermentu kompleksu, pēc kura to uztver aknas un tajā iznīcina.
α 1 Antitripsīnsinhibē trombīnu, XIa faktoru, kallikreīnu, tomēr to neuzskata par svarīgu asinsreces faktoru inhibitoru, α 1 -antitripsīns inhibē aizkuņģa dziedzera un leikocītu proteāzes, kolagenāzi, renīnu un urokināzi audu līmenī.
Peptīdiem, kas veidojas proteolītiskās aktivācijas un profaktoru aktivizācijas rezultātā, ir izteiktas antikoagulantu īpašības, bet to darbības mehānisms vēl nav skaidrs.
D. Trombocītu nozīme hemostāzē
Trombocītu spēja piestiprināt bojāto asinsvadu sienu virsmu (adhēziju) un viens otram (agregācija), saistoties ar fibrīnu, veidojot trombocītu trombu un izdalot hemostatiskos faktorus traumas bojājuma vietā, nosaka to lomu hemostāzē.
Asinīs, kas cirkulē asinīs, ir diska forma un nav pielipuši trauku neskartajam endotēlijam. Adhēzija un agregācija novērš trombocītu un neskartā endotēlija, kā arī prostaciklīna (PG 12) savstarpēju atgrūšanu. Dažu induktoru un trombocītu agregācijas repressora darbības mehānisms ir aplūkots 5. attēlā. 14-17.
Prostaciklīnsveidojas no arahidonskābes asinsvadu endotēlija un iekļūst asinsritē (skatīt 8. nodaļu). Prostaciklīna sintēze un sekrēcija endotēlija šūnās stimulē trombīnu, histamīnu, angiotenzīnu II un kallikreīnu. Tā realizē savu darbību caur adenilāta ciklāzes signālu pārraides sistēmu (skatīt 5. nodaļu). Prostaciklīna mijiedarbība ar receptoru izraisa proteīnkināzes A aktivāciju. Aktīvā proteīna kināze A fosforilē un tādējādi aktivizē Ca2 + -ATP-azu un Ca 2+ translokāzi. Tas noved pie Ca 2+ līmeņa pazemināšanās trombocītu citoplazmā, to diska formas saglabāšanos un samazinātu spēju apkopot.
Trombocītu aktivizēšanu pavada negatīvā uzlādētā laukuma plazmas membrānas parādīšanās, ko veido fosfatidilserīns.
Galvenie trombocītu aktivācijas un agregācijas induktori ir von Willebrand faktors, kolagēns, trombīns, ADP.
Factor von Willebrand -glikoproteīns, kas atrodas asins plazmā, asinsvadu endotēlijā un trombocītu a-granulās. Kuģa sienas bojājuma gadījumā kolagēns, pamatnes membrāna un subendotēlija miocīti mijiedarbojas ar trombocītiem, izmantojot von Willebrand faktoru. Trombocītu plazmas membrāna satur vairākus šāda veida receptorus. Von Willebrand faktors, kas mijiedarbojas ar receptoriem, iedarbojas uz trombocītiem, izmantojot inozitola fosfāta signalizācijas sistēmu (skatīt 5. nodaļu). Galu galā tas noved pie Ca 2+ satura pieauguma trombocītu citoplazmā un kompleksā kalmodulīna-4Ca 2+ - miozīna kināzes veidošanos. Šā kompleksa sastāvā esošais enzīmu miozīna kināzes fosforilē kontrakcijas proteīnu miozīnu, kas mijiedarbojas ar aktīnu, veidojot aktomiozīnu (trombostenīnu). Rezultātā trombocīti iegūst sfērisku formu, veicinot to mijiedarbību ar otru un bojātās endotēlija virsmu.
Fen Willebrand faktora koncentrācijas samazināšana, tā receptoru skaita samazināšana vai struktūras maiņa izraisa adhēzijas traucējumus un trombocītu agregāciju, ko papildina asiņošana. Tas novērots Bernard-Soulier sindroma dēļ, jo trūkst von Willebrand faktora receptoru glikoproteīna Ia trombocītos un von Willebrand slimības dēļ, jo trūkst von Willebrand faktora.
Svarīgākie trombocītu aktivācijas induktori ir trombīns un kolagēns. Šo proteīnu mijiedarbība ar trombocītu plazmas membrānas specifiskiem receptoriem noved pie Ca 2+ mobilizācijas no blīvās cauruļveida sistēmas citoplazmā, kas
galu galā izraisa to saķeri un agregāciju.
Kolagēnsizraisa fosfolipāzes A2 trombocītu aktivāciju, kas atbrīvo arahidonskābi no to membrānas fosfolipīdiem. Arahidonskābe kalpo kā ciklooksigenāzes (COX) fermenta substrāts. Reakcijas rezultātā, ko katalizē ciklooksigenāze, veidojas cikliska endoperekis prostaglandīns G2 (PG G2) un prostaglandīns H 2 (PG H 2). Šie prostaglandīni tiek pārvērsti tromboksānā A 2, lietojot trombocansynthetase (skatīt 8. nodaļu). Tromboksāns A2 samazina cAMP līmeni un, aktivizējot fosfolipāzi C, paātrina Ca 2+ izdalīšanos no blīvās cauruļveida sistēmas (14-17. Att.).
Trombīnsmijiedarbojas ar specifisku receptoru - integrētu proteīnu, kurā ir 7 transmembrānu domēni. Trombīns aktivizē receptoru ar daļēju proteolīzi, no tās izšķiežot N-terminālo peptīdu, kas atrodas trombocītu ārējā plazmas virsmā. Tādēļ trombīns, atšķirībā no citiem aktivatoriem, darbojas katalītiski, un viena trombīna molekula var aktivizēt vairākus receptorus. Signāls tiek pārraidīts

izmantojot inozīta fosfātu sistēmu, kā rezultātā tiek aktivizēta Ca 2+ koncentrācijas palielināšanās trombocītu un proteīna kināzes C gadījumā, kā rezultātā rodas kalmodulīna-4Ca 2+ miozīna kināzes komplekss, kas fosforilē miozīnu, kura mijiedarbība ar aktīnu izraisa trombocītu formas izmaiņas, to saķeri un agregāciju. Turklāt proteīnu kināze C fosforilē trombocītu proteīnu plekstrīnu. Fosetilēts plextrīns izraisa trombocītu saturošu sekundāro trombocītu aktivācijas un agregācijas sekundāro inducējošo reakciju. Šīs vielas ir ADP, Ca 2+, GDF, serotonīns, histamīns un β-tromboglobulīna proteīns, kas atrodas osgranulos, von Willebrand faktors, fibronektīna proteīns, trombospodīns un IUD, kas atrodas blīvās trombocītu granulās. Trombos-podīns ir iesaistīts trombocītu mijiedarbībā. p-tromboglobulīns samazina prostaciklīna sekrēciju un saistās ar heparīnu. Fibronektīnam ir kolagēna, heparīna un trombocītu saistīšanās vietas.
ADP tas ir iekļauts trombocītos, kā arī nonāk asinīs, kad tiek iznīcinātas sarkanās asins šūnas. ADP mijiedarbojas ar specifiskiem receptoriem un inhibē adenilāta ciklāzes aktivitāti. Tas palielina intracelulāro Ca 2+ mobilizāciju un galu galā noved pie trombocītu agregācijas.
Līdz ar to trombocītu aktivizācija ir saistīta ar to metabolisma un bioloģiski aktīvo vielu izdalīšanos. Šīs vielas izraisa morfoloģiskas izmaiņas, adhēziju, trombocītu agregāciju un iesaistās asins recekļa veidošanā.
Receptoru funkcionālās darbības pārtraukšana un trombocītu sekundāro mediatoru sistēma izraisa to funkcijas maiņu un var izraisīt virkni slimību, kas saistītas ar trombozi vai asiņošanu.
Lai novērstu trombozes rašanos, tiek izmantotas zāles, kas pārkāpj trombocītu agregāciju. Aspirīns (ciklooksigenāzes inhibitors), nikotīnskābe (tromboksāna sintetāzes inhibitors) un Ca 2+ blokatori inhibē trombocītu agregāciju, kas ietekmē dažādus trombogēna signāla posmus.
E. Fibrinolīze
Asins receklis izšķīst dažu dienu laikā pēc veidošanās. Fibrinolīze ir fibrīna šķiedru fermentatīvs sadalījums, lai veidotu šķīstošus peptīdus, kas tiek izņemti no asinsvadu gultnes. Fibrīna iznīcināšana trombu sastāvā notiek serīna proteāzes plazmīna iedarbībā.
Plasminveidojas no plazminogēna, darbojoties ar aktivatoriem. Plazmin plazminogēna neaktīvais proenzīms tiek sintezēts aknās, nierēs un kaulu smadzenēs.
Audu plazminogēna aktivators (TAL) -proteolītiskais enzīms, kas atrodas visu audu, izņemot aknu, asinsvadu endotēlijā. Šī aktivatora izdalīšanās asinīs palielinās ar emocionālo stresu, sāpēm, vēnu trombemboliju, mērenu fizisko darbu. TAL inaktīvo plazminogēnu pārvērš par aktīvo plazminu ar daļēju proteolīzi. Plazminogēna aktivatori ir arī XIIa faktors un kallikreīns.
Fibrīna receklis izšķīst fibrīna, plazminogēna un TAP mijiedarbības laikā (14-18. Att.).
Fibrīna šķiedru tīkla veidošanās trombu veidošanās laikā ir saistīta ar plazminogēna un tā aktivatoru sorbciju. Plasmīna un plazminogēna molekulā ir jomas, kas papildina fibrīna domēnus, un viena plazmīna molekula var saistīties ar vairākām fibrīna molekulām. TAP molekulās ir arī fibrīna saistīšanās vietas. Plazminogēns, ko veido TAP plazmīns, hidrolizē fibrīnu, veidojot peptīdus X un Y, kas aktivizē fibrinolīzi, un peptīdus D un E, kas to inhibē. Šķīstošie peptīdi X, Y, D, E nonāk asinsritē un tur ir fagocitēti. Asins recekļu iznīcināšana izraisa plazmīna un TAP izdalīšanos. Asinsritē pēdējās tiek ātri inaktivētas ar specifiskiem inhibitoriem, un tās uztver aknas.
TAP inhibē pirmās (i-TAP-1) un otrā (un-TAP-2) tipa audu aktivatora plazmīna inhibitori un α2-enplasmīna vai citu serīna proteāžu inhibitoru plazmīns.
Nieros tiek sintezēts proteolītisks plazminogēna aktivators, urokināze, kas, konvertējot plazminogēnu uz plazmīnu, veicina

Att. 14-18. Fibrinolīzes shēma. 1 - plazminogēns, kas absorbēts uz fibrīna recekļa aktivatoru iedarbībā (XIIa faktors, kallikreīns, TAP), daļējā proteolīzē pārvēršas plazmīnā; 2 - plazmīns hidrolizē fibrīnu, veidojot šķīstošus peptīdus X, Y, D, E; 3 - asinsritē TAP inaktivējas ar specifiskiem proteīniem i-TAP-1 un i-TAP-2; 4-plazmīna aktivitāte tiek samazināta ar nespecifiskiem serīna proteāžu inhibitoriem (α 2 -antiplasmīns, α 2 -makroglobulīns, α 1 -anta-trippsīns, antitrombīna-heparīna komplekss).
nieru glomerulu izdalīšanās no fibrīna šķiedrām.
No β-hemolītiskā streptokoka tika izdalīts streptokināzes proteīns, kas veido kompleksu ar plazminogēnu, kurā plazminogēns tiek autokatalītiski pārveidots par plazmīnu.
Urokināzi, streptokināzi un TAP lieto miokarda infarkta, venozās un arteriālās trombozes trombolītiskajā terapijā un hemodialīzē.
Šādiem asins koagulācijas fermentu inhibitoriem, piemēram, α 2 -makroglobulīnam, α 1 -antitripsīnam un antitrombīna III-heparīna kompleksam, ir arī neliela fibrinolītiskā aktivitāte.
Asins fibrinolītiskās aktivitātes samazināšanos pavada tromboze. Fibrīna recekļa pārtraukšanu var izraisīt iedzimta plazmīna gēna deficīts vai tās ģenētiskais defekts, plazminogēna aktivatoru plūsmas samazināšanās asinīs un fibrinolīzes inhibitoru satura palielināšanās asinīs (i-TAP-1 un-TAP-2, α 2-antiplasmīns).
Iedzimta un iegūta hemostāzes slimība var izraisīt abas hemorāģiskas slimības, ko raksturo asiņošana un tromboze slimība. Tomēr jāatzīmē, ka paaugstināta trombozes un intravaskulārās koagulācijas (trombofilijas) tendence ir daudz biežāka nekā hemofilija. Piemēram, dažādu hemofilijas formu biežums dažādās valstīs atšķiras no 6 līdz 18 uz 100 000 vīriešiem, bet trombofilija, ko izraisa antitrombīna III deficīts, rodas 1–2 pacientiem ar 5000, bet bez C olbaltumvielas - ar vienu 15 000 pacientu. cilvēks
Asins recēšana Daudzšūnu organisma šūnas dzīvo un nonāk saskarē ar savu šķidrumu. Šī barotne sastāv no asins plazmas, audu šķidruma un limfas, un to sauc par organisma šķidrumu iekšējo vidi. Sastāvā tas atšķiras no ārējās vides, kas apņem visu organismu. Tāpēc gadījumos, kad tiek pārkāpta tās viengabalainība, saglabājot šo šķidro iekšējo vidi, ir būtiska nepieciešamība. Augstā mugurkaulnieku un cilvēku asinīs asins recēšanas sistēma parādījās evolūcijas procesā. Turklāt koagulācijas sistēmas vērtība augstākos organismos ir daudz plašāka nekā hemostāzes jēdziens vai asiņošanas apturēšana, pārkāpjot asinsvadu sienas integritāti.
Asins koagulācija ir ķermeņa aizsargājoša reakcija. Asins, kas izdalās no trauka, koagulē 3-4 minūšu laikā, t.i., tas iet no šķidruma līdz gēla līdzīgam stāvoklim. Asins koagulācija ir saistīta ar faktu, ka šķīstošais fibrinogēna asins plazmas proteīns pārvēršas nešķīstošā fibrīnā.
Asins koagulācija notiek vairākos posmos. Pirmais posms, primārā hemostāze vai priekšfāze, kā tas bija, sākas un sākas otrā posma - faktiski koagulācija, kas savukārt ir daudzfāžu process. Tās būtība sastāv no ķīmiskām enzīmu reakcijām, kuru rezultātā asins koagulācijas faktoros parādās aktīvās vielas.
Primārā hemostāze
Tas ir komplekss fizioloģisks process, kas notiek vairākos posmos. Tās galvenie dalībnieki ir kuģa siena, nervu sistēma un trombocīti. Primārā hemostāze sākas galvenokārt ar refleksu dabas primāro asinsvadu spazmu. Tad sākas tā sauktā endotēlija-trombocītu reakcija. Traumas vietā kuģa endotēlijs maina uzlādi. Trombocīti, kas ieņem marginālo stāvokli traukā, sāk piestiprināties (piestiprināties) pie trauka bojātās virsmas un aglutinējas (sasiet kopā) savā starpā. Rezultātā pēc 2-3 minūtēm sākas trešais posms - trombocītu naga veidošanās fāze. Šajā fāzē asiņošana apstājas, tomēr asins recēšana vēl nav notikusi; asins plazma paliek šķidra. Iegūtais trombs ir vaļīgs, un īsā laikā procesi ir atgriezeniski. Ceturtais posms ir tāds, ka radušos trombos sākas trombocītu morfoloģiskās transformācijas, kas novedīs pie neatgriezeniskām pārmaiņām un iznīcināšanu. Tas ir viskozs trombocītu metamorfoze. Viskozas metamorfozes rezultātā tajā esošie koagulācijas faktori iznāk no trombocītiem. To mijiedarbība izraisa trombīna pēdas, kas izraisa ķīmisko enzīmu reakciju kaskādi - enzīmu koagulāciju.
Enzīmu koagulācija
Trombīna pēdu parādīšanās izraisa tā saucamā enzīmu koagulācijas sarežģīto procesu.
Pirmais enzīmu koagulācijas posms sākas asins un audu koagulācijas faktoru daudzpakāpju mijiedarbības rezultātā, kad asinīs parādās iepriekš trūkstošais faktors, tromboplastīns. Otrais posms ir tromboplastīna mijiedarbība ar protrombīnu, kas ir trombīna neaktīvais prekursors. Tromboplastīna un protrombīna mijiedarbības rezultātā kalcija sāļu klātbūtnē asinīs parādās aktīvs trombīns koncentrācijā, kas ir pietiekama, lai sāktu koagulācijas stadiju - trombīna mijiedarbību ar šķīstošo fibrinogēnu un pēdējo pāreju uz nešķīstošu fibrīnu. Šis ir trešais posms. Atbilstoši pirmajiem fibrīna pavedieniem klīnikā tiek noteikts asins recēšanas laiks.
Tādējādi asins koagulācijas process notiek trīs posmos: 1 - aktīvā tromboplastīna veidošanās, 2 - aktīvā trombīna parādīšanās un 3 - nešķīstošu fibrīna pavedienu nokrišana.
Tad sākas nākamais enzīmu posms, kura laikā asins receklis kondensējas un saspiež, atdala skaidru, šķidro serumu, kas zaudējis spēju sarecēt. Tas ir ceturtā asins recēšanas - asins recekļu atsaukšanas (saspiešanas) posms. Un visbeidzot, pēdējais piektais posms sākas - asins recekļa līze (izšķīdināšana). Tas ir arī daudzpakāpju process, kurā notiek daudzu vielu enzīmu mijiedarbība, kas galu galā noved pie aktīvā enzīma - fibrinolizīna parādīšanās. Fibrinolizīns iznīcina saikni starp fibrīna pavedieniem un atkal pārvērš nešķīstošā fibrinogēnā. Pašlaik ir ierasts runāt par neatkarīgas ķermeņa fibrinolītiskās sistēmas pastāvēšanu. Protams, šie procesi organismā ir daudz sarežģītāki, un tajos piedalās daudzi citi faktori.
Rotējoša asins sistēma (sinh.: koagulācijas sistēma, hemostāzes sistēma, hemocagulācija) - fermentu sistēma, kas aptur asiņošanu, veidojot fibrīna trombu, saglabājot asinsvadu integritāti un asins stāvokli. S. p. - funkcionālā daļa fiziol. asins agregācijas stāvokļa regulēšanas sistēmas (skatīt).
Asins koagulācijas teorijas pamatus (sk.) Izstrādāja A. A. Šmidts. Viņš formulēja teoriju par divfāzu asins koagulāciju, saskaņā ar asins koagulācijas pirmā fāzes samazinājumu, ko izraisīja enzīmu reakcijas, veidojas trombīns (skatīt), otrajā fāzē trombīna ietekmē fibrinogēns (skat.) Pārvēršas fibrīnā (skatīt). 1904. gadā Moravitz (R.O. Morawitz), tad Salibi (V.Salibi, 1952) un Ovren (PA Owren, 1954) atklāja tromboplastīnu veidošanos plazmā un parādīja kalcija jonu lomu protrombīna (skat.) Pārveidošanā. trombīns. Tas ļāva formulēt trīsfāžu asins koagulācijas teoriju, saskaņā ar kuru process notiek secīgi: pirmajā fāzē tiek veidota aktīvā protrombināze, otrajā - trombīna veidošanās, trešajā - fibrīna parādīšanās.
Saskaņā ar McFarlen shēmu asins koagulācija turpinās kaskādes tipā, t.i., neaktīvais faktors (proferācija) pakāpeniski tiek pārveidots par aktīvu fermentu, kas aktivizē nākamo faktoru. Tādējādi asins koagulācija ir sarežģīts, daudzpakāpju mehānisms, kas darbojas pēc atgriezeniskās saites principa. Šādas transformācijas procesā turpmākās transformācijas ātrums un aktivētās vielas daudzums palielinās.
Asins koagulācija, kas ir enzīmu reakcija, ietver plazmas, trombocītu un audu sastāvdaļas, ko sauc par asins koagulācijas faktoriem (skatīt Hemostāze). Ir plazma (prokoagulanti), audu (asinsvadu) un šūnu (trombocītu, eritrocītu uc) asins koagulācijas faktori.
Galvenie plazmas faktori ir faktors I (skatīt Fibrinogēnu), II faktors (skatīt protrombīnu), III faktors vai audu tromboplastīns, IV faktors vai jonizēts kalcijs, VII faktors vai Kollera faktors (skatīt Proconvertīnu), faktori V, X , XI, XII, XIII (sk. Hemorāģisko diatēzi), VIII un IX faktori (skatīt Hemofiliju); III faktors (tromboplastiskais faktors) - fosfolipoproteīns, atrodams visos ķermeņa audos; mijiedarbojoties ar VII faktoru un kalciju, tas veido kompleksu, kas aktivizē X faktoru. II, V (Ac-globulīns), VII, IX, X, XI, XII un XIII faktori ir fermenti; VIII faktors (antihemofilais globulīns - AGH) ir spēcīgs koagulējošo fermentu paātrinātājs, kas kopā ar faktoru I veido ne-fermentu grupu.
Asins koagulācijas un fibrinolīzes aktivizācijas procesā iesaistīti audu faktori, kallikreīna-kinīna enzīma sistēmas komponenti (skatīt Kinins): plazmas prekallikreīns (Fletcher faktors, faktors XIV) un augsta molekulārā kininogēns (Fitzgerald faktors, Williams faktors, Flogger faktors, faktors XV). Audu faktori ietver von Willebrand faktoru, ko sintezē asinsvadu endotēlijā, aktivatorus un fibrinolīzes inhibitorus (skatīt), prostaciklīns ir trombocītu agregācijas inhibitors, kā arī sub-endotēlija struktūras (piemēram, kolagēns), kas aktivizē XII faktoru un trombocītu saķeri (skatīt). .
Koagulējošo trombocītu faktoru grupu sauc par šūnu asins faktoriem, no kuriem vissvarīgākie ir fosfoligda (membrānas) trombocītu faktora 3 (3 tf) un olbaltumvielu antiheparīna faktors (4. faktors), kā arī tromboksāns Ar (prostaglandīns G2), eritrocītu-ny trombocītu faktora 3 analogs (eritroplastīns, eritrocitīns) utt.
Nosacīti asins koagulācijas mehānismu var iedalīt ārējā (ko izraisa audu tromboplastīna iekļūšana asinīs) un iekšējo (ko izraisa asins vai plazmas enzīma faktori) līdz rudzim līdz faktora X aktivācijas fāzei vai Stuart-Prauera faktors un protrombināzes kompleksa veidojumi tiek veikti zināmā mērā atsevišķi, iesaistot dažādus koagulācijas faktorus, un pēc tam tos īsteno pa kopīgu ceļu. Diagrammā parādīts asins koagulācijas kaskādes komplekss.
Pastāv sarežģītas attiecības starp abiem asins koagulācijas mehānismiem. Tādējādi ārējā mehānisma ietekmē tiek veidoti nelieli trombīna daudzumi, kas ir pietiekami tikai trombocītu agregācijas stimulēšanai, trombocītu faktoru atbrīvošanai, VIII un V faktora aktivizēšanai, kas pastiprina X faktora turpmāku aktivizāciju. Asins koagulācijas iekšējais mehānisms ir sarežģītāks, bet tā aktivācija nodrošina X faktora masveida transformāciju trombīnā attiecīgi Xa faktors un protrombīns. Neskatoties uz XII faktora šķietamo nozīmīgo lomu asins koagulācijas mehānismā, tad, kad tas ir nepilnīgs, nav asiņošanas, tikai notiek asins koagulācijas ilgums. Varbūt tas ir saistīts ar trombocītu spēju apvienot ar kolagēnu vienlaicīgi aktivizēt IX un XI faktorus bez XII faktora līdzdalības.
Kallikreīna-kinīna sistēmas komponenti ir iesaistīti asins koagulācijas sākuma stadiju aktivizēšanā, XII faktors ir stimulants. Kallikreīns piedalās XI 1a un XI faktoru mijiedarbībā un paātrina VII faktora aktivāciju, tas ir, kā saikne starp iekšējiem un ārējiem asins koagulācijas mehānismiem. XV faktors piedalās arī XI faktora aktivizēšanā. Dažādos asins koagulācijas posmos veidojas sarežģīti proteīna-fosfolipīdu kompleksi.
Garozā tiek veikts laiks kaskādes shēmas izmaiņām un papildinājumiem.
Asins koagulācija, ko veic iekšējais mehānisms, sākas ar XII faktora aktivāciju (kontakta faktoru vai Hagemana faktoru), nonākot saskarē ar kolagēnu un citiem saistaudu komponentiem (ja asinsvadu siena ir bojāta), kad asinsritē parādās katecholamīnu (piem., Adrenalīna) pārpalikums. kā arī sakarā ar asins un plazmas saskari ar svešzemju virsmu (adatām, stiklu) ārpus ķermeņa. Tajā pašā laikā veidojas tā aktīvā forma - HNa faktors, kas savienojas ar trombocītu 3 faktoru, kas ir fosfolipīds (3 TF), kas darbojas kā XI faktora enzīms, pārvērš to par aktīvo formu X1a. Kalcija joni šajā procesā nav iesaistīti.
IX faktora aktivācija ir X1a faktora enzimātiskās iedarbības rezultāts, un faktora 1Xa veidošanai ir nepieciešami kalcija joni. VIII faktora (Villa faktora) aktivācija notiek faktora 1Xa ietekmē. X faktora aktivāciju izraisa IXa, Villa un 3 TF faktoru komplekss kalcija jonu klātbūtnē.
Ārējā asins koagulācijas mehānismā audu tromboplastīns no audiem un orgāniem asinīs aktivizē VII faktoru un kopā ar to kalcija jonu klātbūtnē veido X faktora aktivitāti.
Iekšējo un ārējo mehānismu vispārējais ceļš sākas ar faktora X, salīdzinoši stabila proteolītiskā enzīma, aktivāciju. X faktora aktivizācija tiek paātrināta 1000 reizes, kad tā mijiedarbojas ar faktoru Va. Protrombināzes komplekss, ko veido Xa faktora mijiedarbība ar Va faktoru, kalcija joniem un 3 tf, izraisa II faktora (protrombīna) aktivāciju, kā rezultātā rodas trombīns.
Pēdējais asins koagulācijas fāze ir fibrinogēna pārveidošanās par stabilizētu fibrīnu. Trombīns - proteolītisks enzīms - no fibrinogēna alfa un beta ķēdēm sašķeļas pirmie divi peptīdi A, tad divi B peptīdi, kā rezultātā ir fibrīna monomērs ar četrām brīvām saitēm, pēc tam apvienoties ar nestabilizēta fibrīna polimēru šķiedrām. Pēc tam, iesaistot XIII faktoru (fibrīna stabilizējošo faktoru), ko aktivizē trombīns, stabilizējas vai nešķīst, veidojas fibrīns. Fibrīna receklis satur daudz sarkano asins šūnu, balto asins šūnu un trombocītu, kas arī nodrošina tās konsolidāciju.
Tādējādi ir konstatēts, ka ne visi olbaltumvielu koagulācijas faktori ir fermenti un tādēļ nevar izraisīt citu proteīnu sadalīšanos un aktivāciju. Tika arī konstatēts, ka dažādos asins koagulācijas posmos veidojas faktoru kompleksi, kuros tiek aktivizēti fermenti, un ne-enzimatiskie komponenti paātrina un uzlabo šo aktivāciju un nodrošina specifisku iedarbību uz substrātu. No tā izriet, ka kaskādes shēma ir jāuzskata par kaskādes kompleksu. Tas saglabā dažādu plazmas faktoru mijiedarbības secību, bet nodrošina kompleksu veidošanos, kas aktivizē turpmākajos posmos iesaistītos faktorus.
Asins koagulācijas sistēmā arī izdalīja tā saukto. asinsvadu-trombocītu (primāro) un asinsreces (sekundāro) hemostāzes mehānismu (skatīt). Kad asinsvadu trombocītu mehānisms tiek novērots, bojātā trauka nosprostojums ar trombocītu masu, ti, šūnu hemostatiskā spraudņa veidošanos. Šis mehānisms nodrošina diezgan ticamu hemostāzi mazos asinsvados ar zemu asinsspiedienu. Ja trauka siena ir bojāta, rodas spazmas Atklāta kolagēna un pamatnes membrāna izraisa trombocītu saķeri ar brūces virsmu. Pēc tam parādās trombocītu agregācija un agregācija asinsvadu bojājumu jomā, piedaloties von Willebrand faktoram, rodas trombocītu koagulācijas faktoru atbrīvošanās, otrais trombocītu agregācijas posms, sekundārā asins spazmas, fibrīna veidošanās. Fibrīna stabilizējošais faktors ir iesaistīts augstas kvalitātes fibrīna veidošanā. Nozīmīga loma trombocītu trombu veidošanā pieder ADP, kāpuma ietekmē kalcija jonu klātbūtnē, trombocīti (skat.) Pielipās viens otram un veido agregātu. ADP avots ir asinsvadu sienas, eritrocītu un trombocītu sienu ATP.
Koagulācijas mehānismā galvenā loma ir S. lappuses faktoriem. v. Asinsvadu trombocītu izolācija un hemostāzes koagulācijas mehānismi ir relatīvi, jo abi parasti darbojas kā konjugāts. Līdz brīdim, kad asiņošana notiek pēc traumatiska faktora iedarbības, iespējams, ir iespējams noteikt tā cēloni. Ar plazmas faktoru defektiem tas notiek vēlāk nekā trombocitopēnijā (skatīt).
Ķermenī kopā ar asins koagulācijas mehānismiem pastāv mehānismi, kas atbalsta asinsrites šķidrumu. Saskaņā ar B. A. Kudryashova teoriju šo funkciju veic tā saucamais. antikoagulantu sistēma, galvenā griezuma saikne ir fermentatīvā un ne-enzimātiskā fibrinolīze, kas nodrošina asins šķidruma stāvokli asinsritē. Citi pētnieki (piemēram, A. A. Markosyan, 1972) uzskata, ka antikoagulācijas mehānismi ir daļa no vienas koagulācijas sistēmas. Ir konstatēta S. savstarpējā saistība. jo ne tikai ar fibrinolītisko sistēmu, bet arī ar kinīniem (skatīt) un komplementu sistēmu (skatīt). Aktivizētais XII faktors ir to izraisītājs; turklāt tas paātrina VII faktora aktivizēšanos. Saskaņā ar 3. S. Barkaganu (1975) un citiem pētniekiem, XII faktors sāk darboties - vienlaikus tiek aktivizēts kalikreīna „tilts” starp iekšējiem un ārējiem asins koagulācijas un fibrinolīzes mehānismiem. Antikoagulantu sistēmai (antikoagulatīvai sistēmai) ir reflekss. Tas tiek aktivizēts, stimulējot asinsrites ķīmoreceptorus, jo asinsritē parādās relatīvais trombīna pārpalikums. Tā efektora darbību raksturo heparīna (skatīt) un fibrinolīzes aktivatoru izdalīšanās asinsritē no audu avotiem. Heparīns veido kompleksus ar antitrombīnu III, trombīnu, fibrinogēnu un vairākiem citiem trombogēniem proteīniem, kā arī katecholamīniem. Šiem kompleksiem piemīt antikoagulanta aktivitāte, lizē nestabilizēts fibrīns, bloķē fibrīna monomēra polimerizāciju ne-enzimatiski un ir XIII faktora antagonisti. Pateicoties enzīmu fibrinolīzes aktivācijai, notiek stabilizēto trombu līze.
Kompleksā proteolītisko enzīmu inhibitoru sistēma inhibē plazmīna, trombīna, kalicireīna un aktivēto koagulācijas faktoru aktivitāti. To darbības mehānisms ir saistīts ar proteīna-proteīna kompleksu veidošanos starp fermentu un inhibitoru. Tika konstatēti 7 inhibitori: a-makroglobulīns, tripsīna inhibitors, Cl-inaktivators, alfa-1-antimotripsīns, antitrombīns III, alfa-2-antiplasmīns, antitripsīns. Heparīnam ir tūlītēja antikoagulanta iedarbība. Galvenais trombīna inhibitors ir antitrombīns III, kas saistās ar 75% trombīna, kā arī citi aktivēti koagulācijas faktori (1Xa, Xa, CPA) un kallikreīns. Heparīna klātbūtnē antitrombīna III aktivitāte dramatiski palielinās. A2 "MacR ° globulīns, kas nodrošina 25% asins antitrombīna potenciāla un pilnībā inhibē kallikreīna aktivitāti, ir svarīgs asins koagulācijas procesam. Bet galvenais kallikreīna inhibitors ir Cl-inhibitors, kas inhibē XII faktoru. Fibrīnam ir arī antitrombīna efekts. fibrīna / fibrinogēna proteolītiskās noārdīšanās produkti, kuriem ir antipolimēru efekts uz fibrīnu un fibrinopeptīdiem, kas tiek atdalīti no fibrinogēna ar trombīnu, S. s.k. darbības pārtraukšana izraisa augstu enzīma plazmīna aktivitāti (skat. Fiber noliz).
Koagulācijas faktori organismā satur daudz vairāk, nekā nepieciešams, lai nodrošinātu hemostāzi. Tomēr asinis nesaglabājas, jo ir antikoagulanti, un hemostāzes procesā tikai neliels daudzums koagulējošo faktoru, piemēram, protrombīns, tiek patērēts, jo tas kavē hemocagulāciju, kā arī neuroendokrīnie regulēšanas mehānismi.
Pārkāpumi S. p. var kalpot par pamatu patolam. procesi, kas klīniski izpaužas asinsvadu trombozes formā (skatīt. Tromboze), hemorāģiskā diatēze (skatīt), kā arī ar to saistītie traucējumi asins kopējā agregācijas stāvokļa sistēmā, piemēram, trombohemorāģiskais sindroms (skatīt) vai Machabeli sindroms. Hemostāzes izmaiņas var būt saistītas ar dažādām trombocītu anomālijām, asinsvadiem, plazmas koagulācijas faktoriem vai to kombināciju. Pārkāpumi var būt kvantitatīvi un (vai) kvalitatīvi, ti, saistīti ar trūkumu vai pārmērīgu faktoru, tās darbības vai struktūras traucējumiem, kā arī izmaiņām asinsvadu, orgānu un audu sienās. Tās iegūst (toksisko ķīmisko savienojumu, infekciju, jonizējošā starojuma, proteīnu, lipīdu vielmaiņas, vēža, hemolīzes), iedzimtu vai iedzimtu (ģenētisku defektu) ietekmi. Starp iegūtajiem pārkāpumiem, kas noved pie novirzēm S. p. visbiežāk sastopamas trombocitopēnija (skatīt), kas saistītas ar smadzeņu, napra, hipoplastiskas anēmijas (skatīt) vai ar trombocītu, napr, pārmērīgu iznīcināšanu pie Verlgof slimības (skatīt Purpura trombocitopēnisko). Bieži sastopamas arī iegūtas un iedzimtas trombocitopātijas (skatīt), rudzi veido trombocītu (piemēram, membrānu glikoproteīnu trūkums), to fermentu un trombocītu atbrīvošanās reakcijas, kas mazina to spēju agregēties vai saķert, kvalitatīviem defektiem. trombocītu koagulācijas faktoru saturs utt.
Paaugstināta asiņošana var rasties koagulācijas faktoru trūkuma vai specifisku antivielu inhibēšanas dēļ. Tā kā aknās veidojas daudzi asins koagulācijas faktori, bieži rodas asiņošana, jo samazinās II, V, VII, IX, X, vai aknu dis (hipo) fibrinogenēmijas koncentrācija. K-vitamīna atkarīgo faktoru (II, VII, IX, X) trūkums, dažos gadījumos kopā ar asiņošanu, tiek novērots, pārkāpjot žults plūsmu zarnās (obstruktīva dzelte), pārmērīgu K vitamīna antagonistu (kumarīnu, varfarīna), zarnu disbakteriozes un hemorāģiskās slimības uzņemšanu jaundzimušajiem (skatīt Hemorāģisko diatēzi).
S. aktivācijas rezultātā. jo īpaši, audu tromboplastīni (ķirurģija, smagi ievainojumi, apdegumi, šoks, sepse utt.), pilnīga un nepilnīga izdalīta intravaskulāra koagulācija bieži rodas (skatīt Thrombohemorrhagic sindromu), kuru ir grūti izlabot, kam nepieciešama dinamiska kontrole. S. rādītāji. uz
Iedzimta vai iegūta galvenā fiziola trūkums veicina izdalītās asins koagulācijas un trombozes veidošanos. antikoagulanti, īpaši antitrombīns III, un fibrinolītiskās sistēmas sastāvdaļas. Šo vielu sekundārā izsmelšana, kas prasa asins pārliešanu aizvietotājterapiju, var būt to intensīva patēriņa rezultāts gan asins koagulācijas procesā, gan intensīvā heparīna lietošanā, kas palielina antitrombīna III, fibrinolīzes aktivatoru (piemēram, streptokināzi) metabolizāciju, samazinot plazminogēna līmeni asinīs. .
Lipīdu vielmaiņas un iekaisuma procesu pārkāpumi asinsvadu sienās noved pie strukturālām izmaiņām asinsvadu sieniņās, organiskā lūmena sašaurināšanos, kas var kalpot kā stimuls asins recekļa veidošanai (piemēram, miokarda infarkta gadījumā). Pārmērīga eritrocītu iznīcināšana, kas satur tromboplastiskus faktorus, bieži ir arī priekšnoteikums asins recekļu veidošanai, piemēram, paroksismālas nakts hemoglobinūrijas un autoimūnās hemolītiskās anēmijas laikā (skatīt Hemolītisko anēmiju), sirpjveida šūnu anēmiju (skatīt).
Visbiežāk koagulācijas faktoru trūkums ir ģenētiski noteikts. Tādējādi VIII, IX, XI faktoru trūkums novērots pacientiem ar hemofiliju (skatīt). Palielināta asiņošana izriet no II, V, VII faktoru trūkuma (skatīt hipoproconvertīnu), kā arī X, XIII un hipofibrinogenēmijas vai afibrinogenēmijas faktoriem (skatīt).
Iedzimta trombocītu funkcionālā mazvērtība ir pamatā lielai slimību grupai, piemēram, Glantsmana trombastēnija, ko raksturo trombocītu agregācijas samazināšanās un asins recekļa atgriešanās (skatīt Trombocitopātiju). Ir aprakstīta hemorāģiskā diatēze, kas rodas ar trombocītu granulu sastāvdaļu atbrīvošanās reakcijas traucējumiem vai ar ADP un citu agregācijas stimulantu (tā saukto akumulācijas baseinu slimību) trombocītu uzkrāšanos. Bieži vien trombocitopātija kombinācijā ar trombocitopēniju (Bernarda slimība - Soulier uc). Trombocītu agregācijas traucējumi, granulu defekts, ADP satura samazināšanās tika novērota ar Chediak-Higashi anomāliju (skatīt Trombocitopātiju). Trombocītu disfunkcijas cēlonis var būt plazmas proteīnu trūkums, kas iesaistīts trombocītu adhēzijas un agregācijas procesos. Tātad Willebrand faktora deficīta gadījumā tiek traucēta trombocītu saķere ar subendotēliju un svešo virsmu, un VIII faktora koagulācijas aktivitāte vienlaikus samazinās, un viens no komponentiem ir Willebrand faktors. Ar von Willebrand-Jurgens slimību (skatīt Angiohemophilia) papildus šiem traucējumiem samazinās trombocītu 3 fosfolipīdu faktora aktivitāte.
Pētījumu metodes S. p. tiek izmantoti, lai noskaidrotu asiņošanas, trombozes un trombohemorāžu cēloņus. Asins recēšanas spējas tiek pētītas ar virkni metožu, pamatojoties uz to-ryh, ir asins recekļa parādīšanās ātruma noteikšana dažādos apstākļos. Visbiežāk izmantotās metodes, kurām ir aptuvena vērtība, ir asins recēšanas laika noteikšana (skatīt), asiņošanas laiks (skatīt), plazmas recalcifikācijas laiks un Ovrene trombotests, ko izmanto, lai uzraudzītu antikoagulantu terapiju. Nosakot plazmas reciklēšanas laiku, pārbaudāmajai plazmai pievieno destilētu ūdeni un kalcija hlorīda šķīdumu; nosakiet asins recekļa veidošanās laiku (laika pagarināšana norāda uz tendenci asiņot, hiperkoagulācijas saīsināšanos). Ovren trombotestā pārbaudāmajai plazmai pievieno reaģentu, kas satur visus asinsreces faktorus, izņemot II, VII, IX un X faktorus; aizkavēta plazmas recēšana norāda uz šo faktoru trūkumu.
Precīzākas metodes ir Zigg metode, ko izmanto, lai noteiktu heparīna toleranci plazmā, tromboelastogrāfiju (skatīt), metodes trombīna laika noteikšanai (skatīt trombīnu) un protrombīna laiku (skatīt), tromboplastīna ģenerēšanas testu vai Biggs metodi tromboplastīna veidošanai. Douglas - metode kaolīna-kefalinovogo laika noteikšanai. Biggs-Douglas tromboplastīna veidošanās metodē pētītajam serumam pievieno veselas personas plazmu un trombocītus, kas apstrādāti ar alumīnija hidrātu; aizkavēta plazmas recēšana šajā gadījumā norāda uz koagulācijas faktoru trūkumu. Lai noteiktu kaolīna-kefalīna laiku, plazmai pievieno kaolīna un kalcija hlorīda šķīduma suspensiju; Līdz plazmas koagulācijas laikam var konstatēt VIII, IX, XI un XII faktora deficītu un antikoagulantu pārpalikumu.
Asins fibrinolītisko aktivitāti nosaka euglobīns, gistokhy. metode utt. (skat. fibrinolīzi). Pastāv arī citas metodes, piemēram, kalikreīna tilta aukstā aktivizēšanās noteikšanai starp faktoriem XII un VII, metodes paracoagulācijas produktu, fizioloģisko antikoagulantu, antitromboplasmas aktivitātes, fibrinogēna noārdīšanās produktu uc noteikšanai.
Bibliogrāfija: Andreenko G.V. Fib-rinolīze, M., 1979, bibliogr .; B Alu-d un V. P. uc Laboratorijas metodes hemostāzes sistēmas izpētei, Tomsks, 1980; Barkagans 3. S. Hemorāģiskās slimības un sindromi, M., 1980; Dzīvnieku un cilvēku bioķīmija, ed. MD Kursk un citi, c. 6, s. 3, 94, Kijeva, 1982; O. Gavrilovs: asins agregācijas stāvokļa sistēmas bioloģiskās likumsakarības un to izpēte, Probl. hematols. un asins pārliešana, 24. sējums, Nr. 7, p. 3, 1979; Akūtas radiācijas slimības hemorāģiskais sindroms, ed. T. K. Dzharakyana, JI, 1976, bibliogr .; Hemofilija un tās ārstēšana, ed. 3. D. Fedorova, L., 1977, bibliogr .; Georgieva S.A. un Kl I hk un n JI. M. Zāļu blakusparādība asins recēšanai un fibrinolīzei, Saratov, 1979, bibliogr .; Gri-ts yu uz A. I. Zāles un asins recēšana, Kijeva, 1978; Kudryashov B. А. Bioloģiskās problēmas asins šķidruma stāvokļa un tā koagulācijas regulēšanā, M., 1975, bibliogr .; Forges uz B. I. un Skipetrov V.P. Asins, asinsvadu sienas, hemostāzes un trombozes veidotie elementi, M., 1974; Markosyan A. A. Asins koagulācijas fizioloģija, M., 1966, bibliogr .; M un-chabelis MS ar agulopātiskiem sindromiem, M., 1970; M. par sh. G. Tromboze un embolijas pie sirds un asinsvadu slimībām, josla ar to. no rumāņiem., Bukareste, 1979; Asins koagulācijas sistēmas ontogenēze, ed. A.A. Markosyan, L., 1968, bibliogr .; Problēmas un hipotēzes asins koagulācijas teorijā, ed. OK K. Gavrilova, M., 1981, bibliogr .; Rabi K. Lokalizēta un izkaisīta vīrusa-sudnālā koagulācija, trans. no Francijas., M., 1974; N. M. un 3 ak un D. D. zh. Antitromboticheskaya terapija, Baku, 1979: Savel'ev V.S., Ya bk par E. G. un To un r un uz A. I. Plaušu artēriju trombembolija, M., 1979; Skipetrov V.P. un K.Z.Z. un B. B. II. Dzemdību trombohemorāģiskais sindroms, Irkutska - ■ Čita, 1973; U un l l par u b un M. Pediatrijas hematoloģija, trans. Ar angļu valodu, M. .. 1981; Filatovs A.N. un Kotovsčina M.A. A. Asins koagulācijas sistēma klīniskajā praksē, L., 1963, bibliogr .; Hruščovs E. A. un Titova M. I. Hemostāzes sistēma sirds, asinsvadu un plaušu ķirurģiskajās slimībās, M., 1974; Chazov E. I. un Lakin K. M. Anticoagulants un fibrinoliticheskie nozīmē, M., 1977; Asins koagulācija un hemostāze, ed. Thomson, Edinburgh - N. Y., 1980; Hemostāze, bioķīmija, fizioloģija un patoloģija, ed. autors: D. Ogston a. B. Bennett, L.-N. Y., 1977; Hemostāze un tromboze, ed. G. G. Neri Serneri a. C. R. Prentice, L. a. o 1979: Cilvēka asins koagulācija, hemostāze un tromboze, ed. autors: R. Biggs, Oxford, 1976; Nilsson I. M. Hemorāģiskas un trombotiskas slimības, L. a. o., 1974; Ķīmiskās fibrinolīzes un trombolīzes attīstība, ed. J. F. Davidson, N. Y., 1978; Ātrās A.J. Hemorāģiskās slimības un hemostāzes patoloģija, Springfield, 1974; Nesenie sasniegumi hemofilijā, ed. Alvortorts, N. Y., 1975; Venozā un arteriālā tromboze, patoģenēze, diagnostika, terapija, ed. autors: J. H. Joist a. L. A. Sherman, N. Y., 1979.
Labi K. Gavrilovs.